La polyarthrite rhumatoïde (PR) est une maladie auto-immune mais dans laquelle les auto-anticorps que sont le facteur rhumatoïde (FR) et les anticorps anti-peptides citrullinés (ACPA ; également appelés anti-CCP) ne sont pas constants : les PR appelées « séropositives » (FR+ et/ou ACPA+, qu’il conviendrait mieux de dénommer immuno-positives) représentent 75 à 80% des PR. Il reste donc 20 à 25% des PR séronégatives (FR- et ACPA-) dont la reconnaissance précoce est rendue plus difficile par l’utilisation des critères de classification européens-américains ACR/EULAR 2010 où le poids des auto-anticorps est très important (Tableau 1). La question de savoir s’il existe une seule PR avec deux visages ou deux maladies de physiopathologie différente reste débattue. Dans le diagnostic (et le suivi) de ces formes séronégatives, comme dans les formes séropositives, l’intérêt de l’échographie articulaire a été récemment souligné. L’IRM a également un intérêt pour la mise en évidence des synovites mais est ciblée sur une articulation ou un groupe articulaire alors que l’échographie permet une analyse de très nombreuses articulations (Figure 1). Un autre axe d’intérêt est représenté par les formes très précoces de PR, avec cliniquement de simples arthralgies mais associées à des auto-anticorps (FR/ACPA), situation où des essais d’intervention thérapeutique ont été menés récemment où sont en cours.
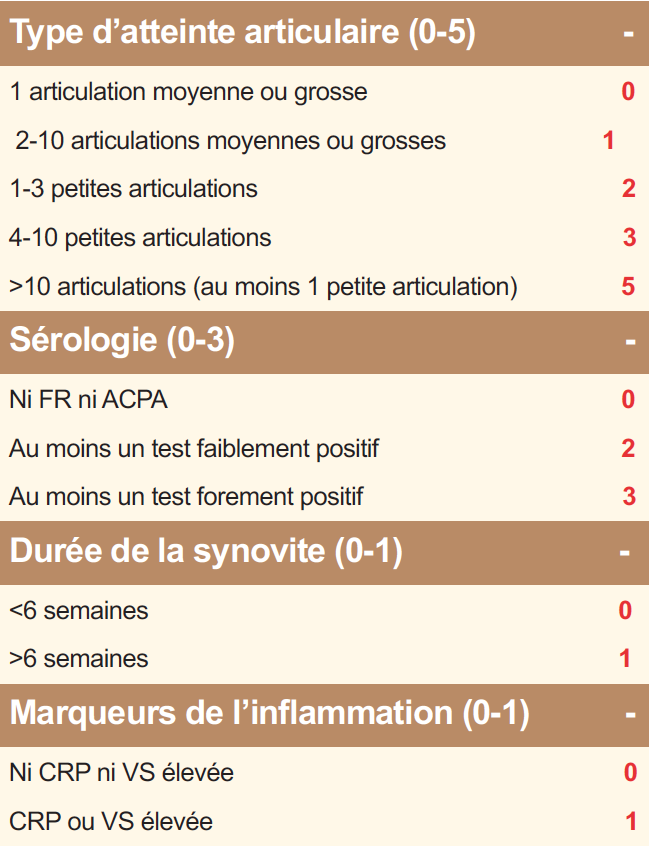
Tableau 1. Critères ACR/EULAR2010 de classification de la polyarthrite rhumatoïde. Le diagnostic de PR est posé si le score est ≥ 6.
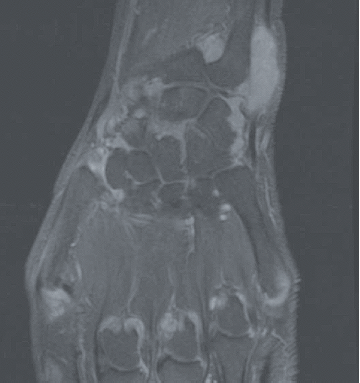
Figure 1. Exemple d’IRM du poignet et des métacarpo-phalangienne au cours de la PR en poussée
Depuis 2014, la stratégie thérapeutique de la PR a peu évolué en Europe, mais diverses avancées ont été faites (Tableau 2). Concernant la trithérapie conventionnelle (association méthotrexate, sulfasalazine, hydroxychloroquine), si elle a l’avantage d’un coût largement inférieur à une biothérapie, son maintien thérapeutique est très faible chez les patients insuffisamment répondeurs au méthotrexate et son utilisation n’a pas connu de développement majeur même s’il s’agit d’une option thérapeutique à ne pas négliger en l’absence de facteurs de mauvais pronostic. Les anti-TNF restent les biothérapies les plus utilisées en première ligne et la question de la stratégie thérapeutique à adopter en cas de réponse insuffisante à cette première ligne d’anti-TNF était resté peu étudiée. C’est tout le mérite de l’essai institutionnel français appelé ROC d’avoir comparé de manière pragmatique chez des patients ayant une PR en réponse insuffisante à une première ligne d’anti-TNF, deux stratégies : deuxième ligne d’anti-TNF ou switch pour une biothérapie ayant un autre mécanisme d’action (tocilizumab, abatacept, rituximab). L’étude française ROC publiée par J-E. Gottenberg et coll. dans la revue JAMA en 2016 –montre une supériorité modérée mais significative de la stratégie de changement de mode d’action. Dans la pratique, chez les patients ayant une efficacité insuffisante d’un anticorps monoclonal anti-TNF, le dosage sérique de la molécule et la recherche d’anticorps anti-médicament peut aider au choix d’une nouvelle ligne de biothérapie.
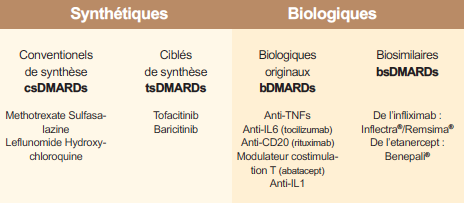
Tableau 2 : La prise en charge de la polyarthrite rhumatoïde (PR) repose essentiellement sur l'utilisation des traitements de fond appelés "disease-modifying antirheumatic drugs" (DMARDs)
Chez les PR en rémission ou en faible activité persistante sous une biothérapie, se pose la question d’un allègement thérapeutique qui permet une baisse des coûts. Cette problématique a pu être étudiée avec les anti-TNF par voie sous-cutanée. L’étude PRESERVE a montré que chez les patients atteignant une faible activité de la PR avec l’association de l'anti-TNF étanercept + méthotrexate, la diminution de la posologie de l’étanercept de 50 à 25 mg/semaine n’altérait pas les résultats. Chez des PR en faible activité ou en rémission sous étanercept ou adalimumab SC, deux essais institutionnels (DRESS en Hollande, STRASS en France) ont adopté une stratégie proche consistant à espacer les injections par paliers. Il a été montré qu’il était à moyen terme possible d’arrêter l’anti-TNF chez 20 à 39% des patients, et d’espacer les injections chez 36 à 43% des patients, ceci sans risque de progression structurale dans la mesure où les patients en rechute ré-intensifiaient leur traitement anti-TNF ce qui leur permettait de retrouver leur état antérieur. L’allègement thérapeutiques a d’autant plus de chance de réussir que la PR est moins ancienne, qu’elle a une activité la plus faible possible et qu’il n’y a pas de synovite Doppler positive à l’échographie.
Depuis 2014, le tocilizumab (inhibiteur de l’IL-6) et l’abatacept (inhibiteur de la costimulation CPA-lymphocytes) sont devenues disponibles par voie sous-cutanée en injection hebdomadaire. Depuis cette date, les biosimilaires sont apparus et sont utilisables en France : le CP-T13 (INFLECTRA® et REMSIMA®) qui est un infliximab IV biosimilaire du REMICADE® ; le SB4 (BENEPALI®) qui est un étanercept biosimilaire de l’ENBREL®. Les biosimilaires ont un coût inférieur à la biothérapie princeps, par exemple de 15% à ce jour pour le BENEPALI® (Tableau 2).
La principale nouveauté thérapeutique réside dans le développement des traitements de fond conventionnels ciblés qui sont des petites molécules ayant des cibles thérapeutiques spécifiques. Ce sont les inhibiteurs des kinases et en l’occurrence des JAK-kinases (4 isotypes JAK1, JAK2, JAK3 et TYK2). Les inhibiteurs des JAK inhibent directement la production des cytokines JAK dépendantes (IFN-γ, IL-6, IL-12, IL-23) et indirectement celle d’autres cytokines pro-inflammatoires (TNF). Le tofacitinib (XELJANZ®) est un inhibiteur de JAK1 et JAK3 qui est démontré efficace dans la PR sur le plan clinique et structural. Après un refus initial en 2013, ce médicament (en association avec le méthotrexate) vient de recevoir un avis favorable de l’EMA le 26 janvier 2017, alors qu’il était déjà commercialisé aux Etats-Unis, au Canada et en Suisse. Le baricitinib est un inhibiteur de JAK1 et JAK2, et son développement est avancé. L’étude RA-BEAM a démontré l’efficacité clinique et structurale du baricitinib dans la PR en échec au méthotrexate et le baricitinib dans cette étude apparait au moins équivalent sinon supérieur cliniquement à l’adalimumab.
La tolérance de tous les traitements de fond est particulièrement surveillée, et ce d’autant plus qu’ils sont récents. L’analyse du registre allemand de biothérapie RABBIT a montré une augmentation de fréquence des perforations digestives basses sous traitement par tocilizumab par rapport aux autres traitements de fond et biothérapies. Le tofacitinib semble entraîner une augmentation de fréquence du zona mais sans augmentation de fréquence des formes graves. De manière générale, les anti-JAK ayant une cible située au sein des voies de signalisation intracellulaire, leur action est susceptible d’entraîner des effets indésirables plus divers que les biothérapies ayant une cible immunologique précise. A cet égard, les registres indépendants de la « vraie vie » constituent et constitueront une source majeure d’analyse de la tolérance si le nombre de patient inclus est suffisant et en l’absence de biais d’inclusion (en France, registres AIR-PR pour le rituximab, ORA pour l’abatacept, RAT pour les anti-TNF et REGATE pour le tocilizumab).
Date de l'article : Juin 2017
References
- Gottenberg JE, Brocq O, Perdriger A, et coll Non-TNF-Targeted Biologic vs a Second Anti-TNF Drug to Treat Rheumatoid Arthritis in Patients With Insufficient Response to a First Anti-TNF Drug: A Randomized Clinical Trial. JAMA. 2016 Sep 20;316(11):1172-1180.
- Gaujoux-Viala C, Gossec L, Cantagrel A, et coll; French Society for Rheumatology. Recommendations of the French Society for Rheumatology for managing rheumatoid arthritis. Joint Bone Spine. 2014 Jul;81(4):287-97.
- Fautrel B, Pham T, Alfaiate T, et coll. Step-down strategy of spacing TNF-blocker injections for established rheumatoid arthritis in remission: results of the multicentre non-inferiority randomised open-label controlled trial (STRASS: Spacing of TNF-blocker injections in Rheumatoid ArthritiS Study). Ann Rheum Dis. 2016 Jan;75(1):59-67.


.png)